Estudos clínicos sem intervenção
e dados da vida real
- Os medicamentos sejam prescritos ou os dispositivos médicos sejam utilizados de acordo com as condições previstas na autorização de introdução no mercado (AIM) ou no procedimento de avaliação
de conformidade, respetivamente; - A inclusão do participante numa determinada estratégia terapêutica não seja previamente fixada
por um protocolo de estudo, mas dependa da prática corrente; - A decisão de prescrever o medicamento ou utilizar um dispositivo médico esteja claramente dissociada
da decisão de incluir ou não o participante no estudo; - Não seja aplicado aos participantes qualquer outro procedimento complementar de diagnóstico ou de avaliação, ou seja, qualquer procedimento adicional, e sejam utilizados métodos epidemiológicos para analisar os dados recolhidos;
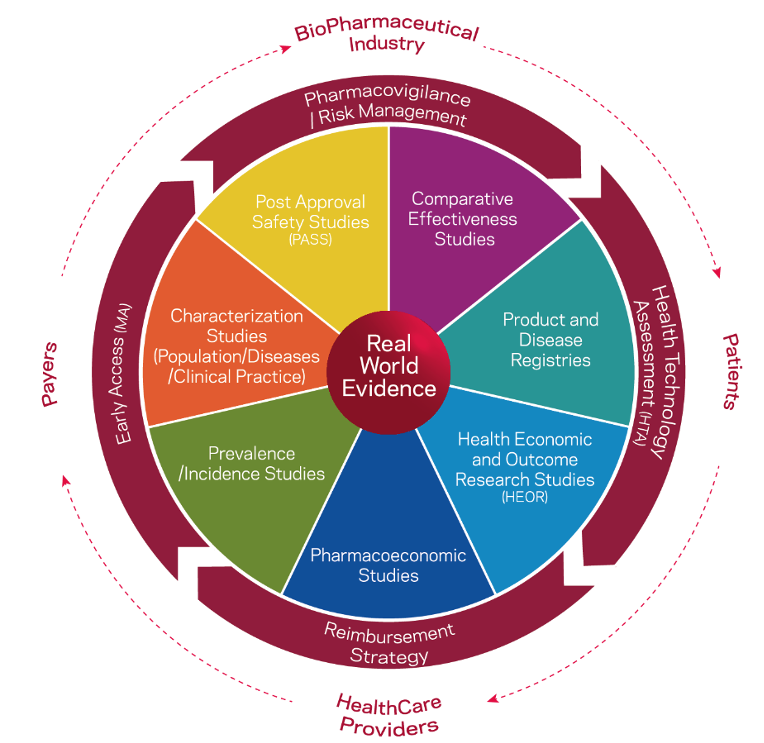
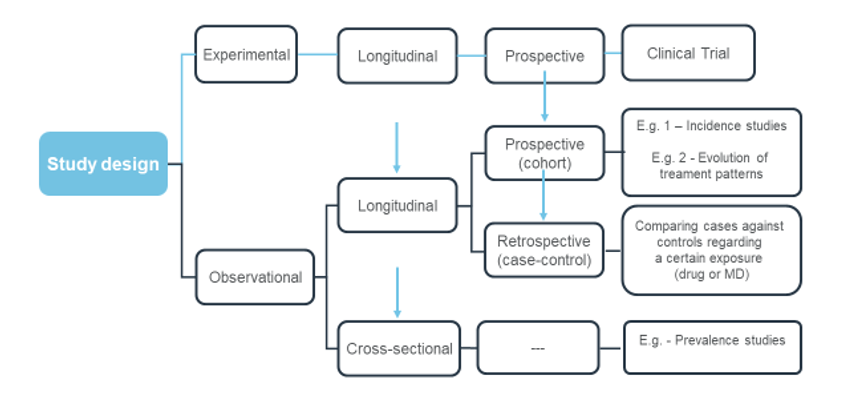
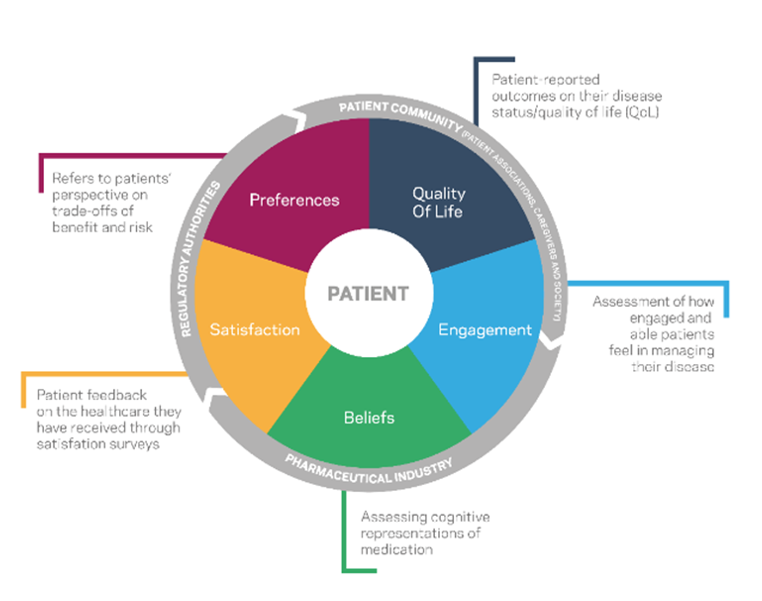
Assim, os estudos clínicos sem intervenção podem ser definidos como estudos em que os medicamentos ou dispositivos médicos são prescritos independentemente da inclusão do participante num estudo. Fazem parte da estratégia terapêutica, de acordo com a prática clínica corrente, e não são definidos previamente por um protocolo de estudo. Podem incluir procedimentos de diagnóstico e acompanhamento do doente, de acordo com a prática clínica corrente. Como tal, estes estudos visam avaliar a utilização de um produto ou de um procedimento clínico, em condições de vida real, podendo incluir, por exemplo avaliação de risco/ benefício, utilização de recursos de saúde ou satisfação de doente e cuidador.
Nos estudos clínicos sem intervenção, os procedimentos clínicos e as avaliações têm de seguir a prática clínica habitual, por oposição aos ensaios clínicos. Como a definição de “prática clínica habitual” pode ser subjetiva e gerar desacordos, a European Medicine Agency (EMA), na sua Guideline on Good Pharmacovigilance Practices (GVP), declara que em estudos clínicos sem intervenção, “entrevistas, questionários, colheitas de sangue e seguimento dos doentes podem ser efetuados como fazendo parte da prática clínica habitual”. De qualquer modo, a aplicação destas avaliações não pode ser efetuada de uma forma que seja considerada significativamente diferente da prática clínica habitual.
Devido à falta de uma orientação ou regulamentação harmonizada na União Europeia, relativamente a estudos clínicos sem intervenção, os promotores e investigadores têm de garantir a segurança dos participantes no estudo, e a colheita de dados de alta qualidade, seguindo um plano de estudo adequado.
Algumas regulações e orientações da UE devem ser seguidas para este efeito, incluindo, mas não limitadas a:
- Regulation 2016/679 on personal data protection
- Directive 2010/84/EU on pharmacovigilance and safety reporting (Article 107)
- Directive 2001/83/EC on labelling requirements
- EMA GVP Module VIII, specific to PASS
- European Centers for Pharmacoepidemiology and Pharmacovigilance considerations on the definition of non-interventional trials
- Guidelines for good pharmacoepidemiology practice
- Applicable legislation and guidance issued by EU Member States